Die Juniorforschungsgruppe Bioprogrammierbare Materialien erforscht ein junges multidisziplinäres Feld, das synthetische Biologie und Biomaterialien kombiniert. Im Mittelpunkt steht die Entwicklung von Materialien mit genetisch programmierten Funktionalitäten, die für Biosensorik geeignet sowie in der Lage sind, auf Stimuli hin Medikamente langfristig freizusetzen und das Zellverhalten zu beeinflussen. Mit Werkzeugen aus der synthetischen Biologie werden Proteine und Mikroben so programmiert, dass sie intelligente und nützliche Funktionen erfüllen. Diese technisierten biologischen Gebilde werden dann in entsprechend entwickelte polymere Matrizen eingearbeitet. Das Ergebnis sind Kompositmaterialien mit sehr vielseitigen Funktionalitäten, einer großen Bandbreite an Steuerbarkeit und in situ-Kontrollmöglichkeiten.
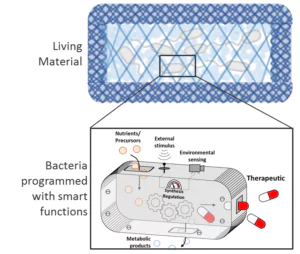
Bakterien werden mit intelligenten Funktionen versehen, beispielsweise für Anwendungen in den Bereichen Biosensorik und Wirkstofftransport

Mitarbeiter/innen
Forschung
In der Gruppe Bioprogrammierbare Materialien kombinieren wir genetisch programmierte lebende Organismen wie Bakterien mit polymeren Matrices wie Hydrogelen, um intelligente Verbundwerkstoffe, so genannte Engineered Living Materials (ELMs), herzustellen. Durch innovative Ansätze bei den lebenden wie bei den nicht-lebenden Materialien sind unsere ELMs für ganze eine Reihe von biomedizinischen Anwendungen wie Biosensorik und Medikamentenabgabe geeignet:
Stimuli-responsive Drug-Sekretion in Bakterien
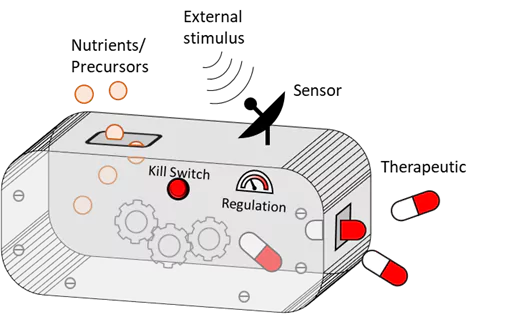
Bakterien sind ein wesentlicher Bestandteil des Mikrobioms des Körpers, wobei mehrere native und probiotische Arten dem Menschen einen natürlichen Gesundheitsschutz verleihen. Bakterien werden auch in der pharmazeutischen Industrie in großem Umfang als Biofabriken zur Herstellung einer Vielzahl von Arzneimitteln eingesetzt. Unsere Forschung vereint diese beiden Merkmale: Wir entwickeln medizinisch relevante Bakterien wie E. coli, Lactobacilli und Corynebacterium, um therapeutische Moleküle direkt im Körper dort zu produzieren und abzusondern, wo sie benötigt werden. Da die Bakterien auf natürliche Weise im Körper gedeihen, kann eine langfristige Freisetzung des Arzneimittels aufrechterhalten werden. Wir designen die Bakterien so, dass sie antimikrobielle, entzündungshemmende und regenerative Medikamente in Form von Peptiden, Proteinen und enzymatisch synthetisierten Biomolekülen zur Behandlung chronischer Krankheiten produzieren und freisetzen.
Patientenprofile und Krankheitsverläufe können sehr unterschiedlich sein. Daher sollte die Aktivität dieser therapeutischen Bakterien so personalisiert und angepasst werden können, dass eine größtmögliche Wirksamkeit sichergestellt ist. Dazu entwickeln wir genetische Module, die die Wirkstofffreisetzung über externe Reize„anschalten“. Stimuli wie Licht, Wärme und kleine Moleküle ermöglichen die Fernsteuerung der Bakterien, und Stimuli wie Biomarker reagieren auf das Fortschreiten der Krankheit und können die Aktivität der Bakterien mittels Autoregulation verändern. Stimuli-responsive genetische Module werden ebenfalls als zusätzliche Ebene der Biosicherheit entwickelt. Damit stellen wir sicher, dass Bakterien nicht außerhalb ihrer vorgesehenen Implantatumgebung überleben. Während viele der von uns verwendeten genetischen Module ursprünglich für E. coli entwickelt wurden, statten wir nun auch probiotische Bakterien wie Laktobazillen und Corynebacterium mit ähnlichen Funktionen aus – eine Herausforderung, die durch die Erweiterung des Spektrums an ELM-fähigen Organismen und Funktionen erhebliche Vorteile verspricht.
Neuste Veröffentlichungen:
- Dhakane, P.; Tadimarri, V. S.; Sankaran, S. Light-Regulated pro-Angiogenic Engineered Living Materials. bioRxiv – https://doi.org/10.1101/2022.10.28.514190.
- Dey, S.; Asensio, M. B.; Kuttae, S. B.; Sankaran, S. Novel Genetic Modules Encoding High-Level Antibiotic-Free Protein Expression in Probiotic Lactobacilli. bioRxiv – https://doi.org/10.1101/2022.08.04.502766.
Hydrogele für die bakterielle Einkapselung und Werkzeuge zum Verständnis des bakteriellen Verhaltens in Gefangenschaft
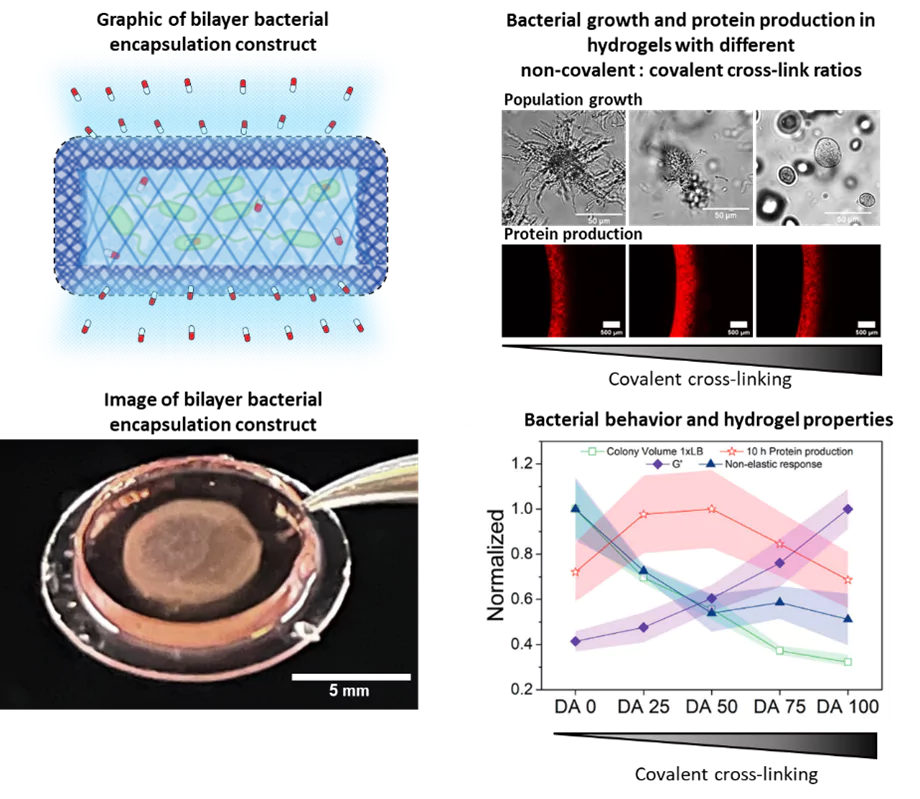
Für die therapeutischen Bakterien zur Behandlung einer Krankheit ist es notwendig, dass sie sich an der Krankheitsstelle ansiedeln und eine ausreichend große Population aufbauen, um wirksame Medikamentendosen bereitzustellen. In Zusammenarbeit mit der Forschungsgruppe Dynamische Biomaterialien entwickeln wir hydrogelbasierte Matrizen, die geeignete Umgebungen für das Wachstum und die Funktion der Bakterien bieten. Diese Hydrogele sind so konzipiert, dass sie die Größe der enthaltenen Bakterienpopulation mechanisch kontrollieren und gleichzeitig deren Funktionalität maximieren. Das Hydrogelnetzwerk ermöglicht die Diffusion von Nährstoffen, Metaboliten und Medikamenten in und aus der Matrix, während es das Entweichen der Bakterien verhindert und Schutz vor Immunzellen bietet. Die Materialkomponente bietet daher eine zusätzliche Ebene der Biosicherheit für den Einsatz von genetisch veränderten Bakterien im Körper.
Im Rahmen dieser Forschung haben wir festgestellt, dass bestimmte mechanische Eigenschaften der Hydrogele das Wachstum und den Stoffwechsel der enthaltenen Bakterien beeinflussen, ähnlich wie es bei natürlichen Biofilmen der Fall ist. Dies wirkt sich wiederum auf die Leistungsfähigkeit der Bakterien in Bezug auf die Reaktion auf Stimuli und die Produktion von Medikamenten aus. Daher untersuchen wir das Verhalten der Bakterien in den eingeschränkten Bedingungen der Hydrogele, deren mechanische Eigenschaften wir steuern können. Dabei erkennen wir das Zusammenspiel zwischen dem kollektiven Verhalten der Bakterien und den sie umgebenden mechanischen Kräften. Neben der Optimierung der Leistungsfähigkeit der von uns entwickelten lebenden Materialien dient dies auch als künstliche Plattform für Biofilme, um grundlegende Erkenntnisse über das mögliche Verhalten von Bakterien in verschiedenen Bereichen natürlicher Biofilme zu gewinnen. Zur Bestimmung des Wachstums und des Stoffwechselverhaltens der Bakterien im Laufe der Zeit nutzen wir Mikroskopie sowie biochemische und genetische Tests.
Neuste Veröffentlichungen:
- Bhusari, S.; Sankaran, S.; del Campo, A. Regulating Bacterial Behavior within Hydrogels of Tunable Viscoelasticity. Advanced Science 2022, 9 (17), 2106026. https://doi.org/10.1002/advs.202106026.
- Bhusari, S.; Kim, J.; Polizzi, K.; Sankaran, S.; Campo, A. del. Encapsulation of Bacteria in Bilayer Pluronic Thin Film Hydrogels: A Safe Format for Engineered Living Materials. bioRxiv – https://doi.org/10.1101/2022.09.29.510162.
Kooperationen:
Diese Forschungsanstrengungen sind auch Teil mehrerer Kooperationen innerhalb zweier Konsortien – (i) Leibniz Wissenschaftscampus – Living Therapeutic Materials (LSC LifeMat) und (ii) Sonderforschungsbereich on Physikalische Modellierung von Nichtgleichgewichtsprozessen in biologischen Systemen (SFB 1027).
Finanzierung:


Publikationen
Blanch-Asensio, Marc | Tadimarri, Varun S. | Wilk, Alina | Sankaran, Shrikrishnan
Microbial Cell Factories , 2024, 23 (42), 1-13.
https://doi.org/10.1186/s12934-024-02302-7
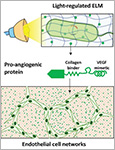
Dhakane, Priyanka | Tadimarri, Varun S. | Sankaran, Shrikrishnan
Advanced Functional Materials , 2023, 33 (31), 2212695.
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202212695
Riedel, Florian | Puertas Bartolomé, María | Teruel Enrico, Lara Luana | Fink-Straube, Claudia | Nguyen Dong, Cao | Gherlone, Fabio | Huang, Ying | Valiante, Vito | del Campo, Aránzazu | Sankaran, Shrikrishnan
Frontiers in Bioengineering and Biotechnology , 2023, 11 1278062.
https://www.frontiersin.org/articles/10.3389/fbioe.2023.1278062/abstract

Bhusari, Shardul | Sankaran, Shrikrishnan | del Campo, Aránzazu
Advanced Science , 2022, 9 (17), 2106026.
https://onlinelibrary.wiley.com/doi/abs/10.1002/advs.202106026
Rodrigo-Navarro, Aleixandre | Sankaran, Shrikrishnan | Dalby, Matthew J. | del Campo, Aránzazu | Salmeron-Sanchez, Manuel
Nature Reviews Materials , 2021, 6 1175–1190.
https://doi.org/10.1038/s41578-021-00350-8

